OS RAIOS CATÓDICOS E O MODELO ATÔMICO DE THOMSON
OS RAIOS CATÓDICOS
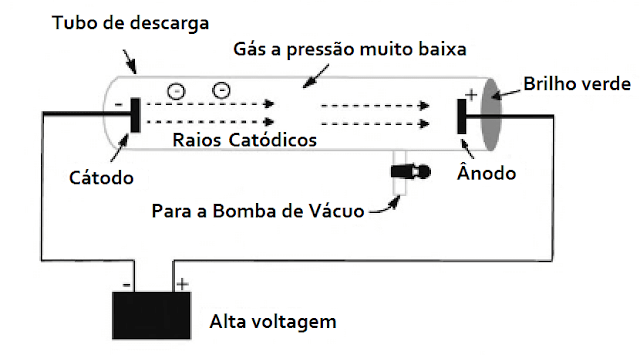
Gases, de modo geral, não conduzem corrente elétrica quando à pressão ambiente. No entanto, na segunda metade do século XIX, os trabalhos de Heinrich Geissler, Johann Hittorf e William Crookes mostraram experimentalmente que, quando submetidos a baixas pressões, os gases podem tornar-se condutores elétricos. Para chegar a essa conclusão, eles utilizaram o chamado tubo de raios catódicos, isto é, uma ampola de vidro ligada a uma bomba de vácuo que visa diminuir a pressão interna. Nas duas pontas do tubo há extremidades metálicas (chamadas de eletrodos) ligadas a uma bateria. Quando a pressão interna chega a cerca de um décimo da pressão ambiente, observa-se que o gás entre os eletrodos passa a emitir uma luminosidade. Quando a pressão diminui ainda mais (cerca de cem mil vezes menor que a pressão ambiente), a luminosidade desaparece, restando apenas uma mancha luminosa atrás do polo positivo.
Os cientistas atribuíram essa mancha a raios (de natureza desconhecida, naquela época) que seriam provenientes do polo negativo, chamado de cátodo. Esses raios foram denominados raios catódicos.
O MODELO ATÔMICO DE THOMSON (MODELO DO PUDIM DE PASSAS)
O modelo atômico proposto por Dalton foi aceito durante praticamente todo o século XIX, porém esse modelo atômico não era possível de explicar a eletricidade e a radioatividade.
Ao analisar o desvio dos raios catódicos em função da tensão elétrica aplicada nos eletrodos, Thomson percebeu que esses raios eram sempre os mesmos. Isso significava que esse raio sempre era atraído para o polo positivo e que sua massa não se alterava. O cientista concluiu que os raios catódicos eram formados por um feixe de partículas idênticas de carga negativa, as quais estavam presentes em toda a matéria e, portanto, no átomo. O nome dado a essas partículas foi elétron.
Thomson confirmou a existência dessas partículas e ainda concluiu com seus trabalhos que a massa dos elétrons deveria ser muito menos do que a dos átomos. Ele elaborou um modelo de átomo constituído por uma esfera maciça, de carga elétrica positiva, que continha "corpúsculos" de carga negativa (elétrons) nela dispersos.

Segundo Thomson, o número de elétrons no átomo deveria ser suficiente para anular a carga positiva da esfera. Assim, se um átomo perdesse um ou mais elétrons, ficaria carregado positivamente, pois haveria uma carga total positiva superior á negativa, transformando-se em um átomo positivamente carregado. Caso o átomo ganhasse um ou mais elétrons, ficaria negativamente carregado. Atualmente, dá-se o nome de íons aos átomos que ficam positiva ou negativamente carregados. Íons com carga elétrica positiva são denominados de cátions, e com carga elétrica negativa, ânions.
Gases, de modo geral, não conduzem corrente elétrica quando à pressão ambiente. No entanto, na segunda metade do século XIX, os trabalhos de Heinrich Geissler, Johann Hittorf e William Crookes mostraram experimentalmente que, quando submetidos a baixas pressões, os gases podem tornar-se condutores elétricos. Para chegar a essa conclusão, eles utilizaram o chamado tubo de raios catódicos, isto é, uma ampola de vidro ligada a uma bomba de vácuo que visa diminuir a pressão interna. Nas duas pontas do tubo há extremidades metálicas (chamadas de eletrodos) ligadas a uma bateria. Quando a pressão interna chega a cerca de um décimo da pressão ambiente, observa-se que o gás entre os eletrodos passa a emitir uma luminosidade. Quando a pressão diminui ainda mais (cerca de cem mil vezes menor que a pressão ambiente), a luminosidade desaparece, restando apenas uma mancha luminosa atrás do polo positivo.
Os cientistas atribuíram essa mancha a raios (de natureza desconhecida, naquela época) que seriam provenientes do polo negativo, chamado de cátodo. Esses raios foram denominados raios catódicos.

O MODELO ATÔMICO DE THOMSON (MODELO DO PUDIM DE PASSAS)
O modelo atômico proposto por Dalton foi aceito durante praticamente todo o século XIX, porém esse modelo atômico não era possível de explicar a eletricidade e a radioatividade.
Ao analisar o desvio dos raios catódicos em função da tensão elétrica aplicada nos eletrodos, Thomson percebeu que esses raios eram sempre os mesmos. Isso significava que esse raio sempre era atraído para o polo positivo e que sua massa não se alterava. O cientista concluiu que os raios catódicos eram formados por um feixe de partículas idênticas de carga negativa, as quais estavam presentes em toda a matéria e, portanto, no átomo. O nome dado a essas partículas foi elétron.
Thomson confirmou a existência dessas partículas e ainda concluiu com seus trabalhos que a massa dos elétrons deveria ser muito menos do que a dos átomos. Ele elaborou um modelo de átomo constituído por uma esfera maciça, de carga elétrica positiva, que continha "corpúsculos" de carga negativa (elétrons) nela dispersos.

Segundo Thomson, o número de elétrons no átomo deveria ser suficiente para anular a carga positiva da esfera. Assim, se um átomo perdesse um ou mais elétrons, ficaria carregado positivamente, pois haveria uma carga total positiva superior á negativa, transformando-se em um átomo positivamente carregado. Caso o átomo ganhasse um ou mais elétrons, ficaria negativamente carregado. Atualmente, dá-se o nome de íons aos átomos que ficam positiva ou negativamente carregados. Íons com carga elétrica positiva são denominados de cátions, e com carga elétrica negativa, ânions.
Comentários
Postar um comentário